Работа с газами. Источники опасности
Многие газы поступают в лаборатории в стальных баллонах в сжатом (азот, аргон, водород, гелий, кислород и др.), сжиженном (аммиак; углеводороды за исключением метана, диоксид углерода, фреоны, хлор и др.) или растворенном (ацетилен) состоянии. Небольшие количества газов при необходимости получают химическими путями непосредственно в лабораториях [46].
По своим опасным свойствам все газы делятся на пять групп, причем некоторые относятся не к одной, а к нескольким группам:
- горючие и взрывоопасные (водород, сероводород, аммиак, оксид углерода, углеводороды);
- поддерживающие горение (кислород, воздух, хлор);
- инертные и негорючие (азот, аргон, гелий, диоксид углерода);
- ядовитые (аммиак, сероводород, фосген, хлор, циановодород, оксид углерода);
- едкие и вызывающие коррозию (хлор, аммиак, озон, хлороводород, диоксид серы, диоксид азота).
Разумеется, принадлежность газов к той или иной группе в некоторой степени условна. Так, хоти диоксид углерода не отнесен ни к горючим, ни к поддерживающим горение, известно, что щелочные металлы горят в его атмосфере. Литий, кроме того, может гореть и в считающемся инертным азоте. Неядовитые инертные газы и диоксид углерода могут вызвать удушье при значительной утечке в замкнутом объеме, вытесняя кислород из зоны дыхания.
Кроме того, приведенная классификация не учитывает всех видов-опасности при работе с газами. Так, . химическая активность газов отнюдь не исчерпывается их корродирующим действием. Ацетилен, например, отнесен к группе взрывоопасных газов,, из-за свойств его смесей с воздухом, а также способности к взрывному разложению в отсутствие кислорода и других; окислителей. Однако не меньшую опасность представляют ацетилениды металлов, которые могут образовываться при взаимодействии ацетилена с водными растворами солей меди, серебра, ртути. При длительном контакте влажного ацетилена, содержащего аммиак, с красной медью или сплавами с содержанием меди выше 70% образуется взрывоопасный ацетиленид меди. В результате взаимодействия диоксида азота с некоторыми органическими соединениями в определенных условиях могут образовываться чрезвычайно взрывоопасные полини-тросоединения.
Опасность работы с баллонами связана не только с горючестью, взрывоопасностью, токсичностью или агрессивностью содержащихся в них газов, но также с высоким давлением газа в баллоне — до 15 МПа, что само по себе может явиться причиной взрыва при падении баллона или его перегреве. Кроме того, при аварийных, утечках газов из баллонов взрывоопасные или поражающие концентрации образуются гораздо быстрее и в больших объемах, чем при разливе горючих или ядовитых жидкостей.
Но, манипулируя с газами в стеклянной аппаратуре даже и при нормальном давлении, следует учитывать, что перечисленные опасные свойства усугубляются их агрегатным состоянием. Если утечка жидкости из прибора во время работы происходит, как правило, только в результате аварии и вряд ли может остаться незамеченной экспериментатором, утечка газа может явиться следствием случайной разгерметизации и внешне никак не проявляться.

В приборах, где происходят химические и физические процессы с участием газообразных веществ, серьезную опасность представляют возможные колебания давления. Особенно велика эта опасность при проведении процессов, связанных с изменением агрегатного состояния — незначительные температурные колебания могут вызвать быстрое испарение сконденсированного газа. Если это обстоятельство не предусмотрено в конструкции прибора, результатом могут быть выброс реакционной массы, взрыв или другие неприятные последствия.
Существует реальная опасность перепутать газ при нечеткой идентификации содержимого баллона. Хотя . маркировка стальных баллонов для газов с обязательным нанесением надписи с названием газа (см, приложение 9), казалось бы, должна исключать ошибки, в обращении иногда находятся баллоны со стершейся надписью. К тому же система отличительной окраски баллонов сложна и не вполне логична. Например, баллоны со сжатым воздухом, являющимся сильным окислителем, окрашены в тот же черный цвет, что и баллоны с инертным азотом и сырым аргоном. Нет нужды объяснять, что ошибочное использование. сжа: того воздуха вместо азота может привести к очень серьезной аварии. Чтобы избежать ошибок, следует категорически отказаться от использования баллонов без надписи или с неразборчивой надписью.
Общие меры предосторожности при работе с газами при атмосферном давлении
Все меры предосторожности при работе с пазами так или иначе направлены на то, чтобы исключить возможность неконтролируемой утечки газов в атмосферу. При работе с горючими и взрывоопасными газами, так же как при работе с ЛВЖ, необходимо удалять или защищать возможные источники воспламенения.
Любые работы, связанные с получением, применением или поглощением пожароопасных, токсичных или агрессивных газов можно проводить только в вытяжном шкафу.
Обеспечение герметичности
При сборке приборов для работы с газами особое внимание следует уделять обеспечению герметичности. Соединение отдельных элементов приборов осуществляют с помощью конусных взаимозаменяемых шлифов, резиновых или полимерных шлангов.
Конусные шлифы должны быть тщательно смазаны (см. разд. 4.8). Особо жесткие требования предъявляются к смазкам для шлифов, контактирующих с агрессивными газами. Для работы с газообразным хлоромт оксидами азота можно рекомендовать смазки на основе олигомеров трифторхлорэтилена: во многих случаях оправдано применение сиропообразной фосфорной кислоты.
При работе с газами обязательным требованием техники безопасности является укрепление шлифов с помощью стальных пружинок или резиновых колечек самопроизвольное разъединение шлифов в ходе работы должно быть полностью исключено.
При соединении частей приборов резиновыми или полимерными шлангами следует учитывать возможность воздействия газов на материал шланга. Если нет уверенности в полной химической индифферентности материала шланга, стеклянные трубки соединяют по возможности встык, как это изображено на рис. 25. В любом случае для сборки приборов следует использовать совершенно чистые, лучше не бывшие в употреблении шланги. Резиновые шланги предварительно тщательно очищают от талька; при необходимости уменьшения их проницаемости для газов и влаги их обрабатывают расплавленной парафин-полиэтиленовой смесью (см. стр. 134). При использовании тонкостенных шлангов из резины, силиконового каучука, поливинил-хлорида следует исключить возможность перегиба шланга в процессе работы.
Вообще при компоновке газовой линии необходимо стремиться к уменьшению длины шлангов; вся установка должна быть компактной и, главное, удобной для работы.
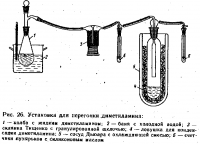
Старший инженер-химик Т. проводила очистку примерно 100 мл жидкого диметиламина (т. кип. +7 °С) на установке, изображенной на рис. 26. С целью очистки и осушки диметиламяи из грушевидной колбы объемом 150 мл переводился в газообразное состояние, пропускался через систему склянок с гранулированной щелочью и затем коиденсировался в приемнике, охлаждаемом сухим льдом. Отдельные детали установки были соединены с помощью шлангов из силиконового каучука. Установка была собрана в вытяжном шкафу; створки шкафа во время работы были опушены.
В ходе работы Т. решила заменить воду в бане на более теплую. Для этого она открыла створку вытяжного шкафа и приподняла перегонную колбу с диметиламином. В этот момент из горла колбы выбило насадку Вюрца и сильная струя паров диметиламина попала в лицо Т. В момент происшествия на пострадавшей был защитный щиток из оргстекла, но он прикрывал лицо лишь до верхней губы и не был до конца опущен, из-за этого пары попали под маску.
Причиной выброса явилось повышение давления в колбе в результате перегиба шланга в момент подъема колбы. Возможно, сыграло роль и более интенсивное испарение диметиламина. при непроизвольном покачивании колбы.
Пострадавшей немедленно была оказана первая помощь — глаза обильно промыты водой и слабым раствором аскорбиновой кислоты. (Хотя в инструкциях по оказанию первой помощи пострадавшим при щелочных ожогах глаз рекомендуется промывание раствором борной кислоты, лечащий врач одобрил применение аскорбиновой кислоты вместо борной.) Несмотря на оказанную помощь, Т. получила ожог роговицы II степени. После интенсивного лечения в стационаре, продолжавшегося две недели, зрение было восстановлено практически полностью.
Приказом по институту пострадавшей был объявлен выговор за нарушение правил техники безопасности, которое, по мнению администрации, заключалось в том, что Т. подняла створки вытяжного шкафа выше допустимой отметки.
Приведённый пример наглядно показывает, насколько важна осмотрительность при работе с агрессивными жидкостями и газами. Помимо слишком высокого подъема створки вытяжного шкафа и небрежно надетой маски к ошибкам пострадавшей следует отнести то, что она подняла перегонную колбу. Правила техники безопасности, при перегонке жидкостей предписывают собирать установку таким образом, чтобы при необходимости можно было опустить обогревающую баню. Перегиб шланга, конечно, случайность, однако вовсе не такая, которую невозможно предусмотреть при аккуратной работе.
Хотелось бы обратить внимание еще на один важный момент, связанный с данным несчастным случаем., Сразу после оказания первой помощи пострадавшая с сопровождающим была отправлена на личной машине одного из сослуживцев в городской глазной травмпункт. Однако окулист травмпункта недооценил опасность ожога и возможность развития поражения. После введения в глаза, раствора дикаина врач выписал рецепты на альбуцид и глазную мазь и отпустил пострадавшую домой. Однако пострадавшая и сопровождающий — опытные химики — не удовлетворились заключением врача, а обратились за консультацией в ведомственную поликлинику, после чего пострадавшая была срочно госпитализирована, поскольку последствия ожога стали особенно активно развиваться спустя несколько часов. Речь шла о возможности полной потери зрения. И лишь своевременное квалифицированное лечение позволило избежать инвалидности. В связи с этим хочется еще раз подчеркнуть, что клиническая картина химических ожогов глаз имеет свою специфику, о чем, как оказалось, не всегда достаточно осведомлены медицинские работники. Тем более важно знание основ оказания первой помощи при отравлениях и химически ожогах каждым работающим в лаборатории.
Перед работой с прибором его обязательно проверяют на герметичность. Наиболее надежна проверка с помощью вакуума — для этого к собранному прибору подсоединяют вакуумметр, откачивают из системы воздух масляным или водоструйным насосом, затем перекрывают вакуумную линию и наблюдают за падением вакуума. Прибору можно считать герметичным, если показания вакуумметра не изменяются в течение по крайней мере нескольких минут.
Контроль и регулирование давления и расхода газа
Если стеклянный прибор для работы с газами не соединяется с атмосферой, он должен быть обязательно снабжен чувствительным манометром, автоматическим регулятором давления (маностатом) или клапаном избыточного давления. Маностат следует отрегулировать таким образом, чтобы избыточное давление в приборе не превышало нескольких десятков миллиметров ртутного столба. Хотя круглодонная стеклянная посуда, используемая для работы под вакуумом, выдерпри избыточном давлении значительно выше, чем при вакуумировании. При необходимости повышения давления в приборе до 1 ат следует принимать особые меры предосторожности. Стеклянные части установки должны быть только толстостенными, а колбы — круглодонными; недопустимы царапины и прочие пороки стекла. Для соединения отдельных частей прибора в этом случае используют только вакуумные шланги, которые обязательно закрепляют на трубках, для чего обматывают в месте крепления изоляционной лентой и прочно прикручивают шнуром или мягкой проволокой.
Если газ подается в прибор из генератора или газового баллона, необходимо контролировать не только давление, но и расход газа. Для этой цели используют различного типа реометры, газовые часы или в простейшем случае — счетчики пузырьков. Работа с неконтролируемыми газовыми потоками не всегда достаточно безопасна.
Предотвращение выброса газа в атмосферу
Наконец, важным, хотя и не всегда соблюдаемым требованием техники безопасности при работах с любыми газами, кроме инертных, является недопустимость выброса газа непосредственно в атмосферу. Выделяющиеся в ходе реакции газообразные вещества, особенно агрессивные и ядовитые, следует поглощать в специальных поглотительных склянках. Во многих случаях при поглощении агрессивных газов не только предохраняется от коррозии расположенная в вытяжном шкафу аппаратура, но и побочно образуются небесполезные в лабораторной практике растворы.
Способы получения небольших количеств газов
Все способы получения газов в лабораторных условиях можно классифицировать следующим образом в соответствии с агрегатным состоянием взаимодействующих веществ и порядком их добавления друг к другу:
1. Взаимодействие жидкостей с твердыми веществами:
- добавление жидкости к твердому веществу по каплям
- автоматическое добавление
жидкости к твердому веществу (аппарат Киппа);
- добавление твердого сыпучего вещества к жидкости;
- другие способы (предварительное смешивание твердоговещества с жидкостью с последующим выделением газа при нагревании; предварительное растворение твердого вещества с последующим добавлением другой жидкости).
2. Взаимодействие двух жидкостей.
- Взаимодействие газа с твердыми и жидкими веществами.
- Выделение газов из растворов или твердых веществ без добавления реагентов (например при нагревании).
Из множества известных в лабораторной практике способов получения газов предпочтение следует отдавать тем, которые обеспечивают получение равномерного, легко контролируемого н регулируемого тока газа; Из многочисленных предложенных для этих целей приборов заслуживают внимание наиболее простые и целесообразные: чем проще конструкция прибора, тем, как правило, безопаснее его эксплуатация.
На рис. 27—32 изображены некоторые универсальные приборы, пригодные для получения самых разных газов. Достоинства и недостатки различных способов разберем на двух конкретных примерах.
Получение хлороводорода.
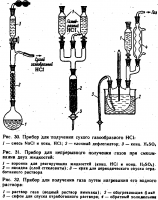
- Небольшие количества сухого НС1 получают прикапыванием концентрированной серной кислоты к кристаллическому ЫаС1 в простейшем приборе, изображенном на рис. 27. Несмотря на простоту, способ во многом неудобен: масса сильно пенится, газ выделяется неравномерно, что создает дополнительные проблемы при его утилизации. К недостаткам способа следует отнести невозможность быстрого прекращения реакции в случае необходимости. Наконец, хлорид натрия используется далеко не полностью, что существенно в данном случае, конечно, не из соображений экономии реактива, а из-за сложностей расчета при необходимости получения заданного количества газа. С целью более полного смешивания реагентов рекомендуется смочить соль концентрированной соляной кислотой. В колбу Вюрца на 100 мл (или одногорлую колбу с насадкой Вюрца) вносят не более 35—40 г NaCl, добавляют конц. НС1 до полного смачивания соли. Прикапывание серной кислоты стараются вести равномерно, не допуская сильного вспенивания массы. В конце процесса для более полного выделения газа колбу нагревают, но не более чем до 100 °С. Выход газообразного HCl в этом случае составляет 2р г из 40 г NaCl.
- При получении газообразного HCl в аппаратеКиппа из кусочков NH4CI и концентрированной H2SO4 также следует иметь в виду, что. выделение газа может происходить неравномерно, с внезапным вспениванием, поэтому аппарат нельзя встряхивать. Очень важно, чтобы кусочки хлорида аммония были достаточно плотными и не рассыпались под действием H2SO4.
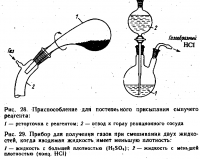
- При необходимостиполучения очень чистого сухо: го HCl иногда прибегают к обратному порядку добавления—осторожно присыпают NH4CI квалификации х. ч. к концентрированной H2S04 в медленном токе индифферентного газа. Удобное приспособление для этой лели изображено на рис. 28. Перед проведением работы необходимо убедиться, что порошок идеально сыпучий, а шлиф реторточки хорошо смазан.
- В полной мере условие получения равномерного, контролируемого тока HCl выполняется при взаимодействии двух жидкостей. При добавлении концентрированной соляной кислоты к конц. H2SO4 более легкую кислоту следует обязательно вводить под массу с помощью оттянутого кончика капельной воронки, как это изображено на рис. 29. При несоблюдении этого правила неизбежно образуется два слоя, смешивание которых' в любой момент может вызвать слишком бурное выделение газа и даже выброс реакционной массы. Из 100 мл соляной кислоты и 100 мл, серной по этому способу получается 30—33 г газообразного HCl. Скорость прибавления соляной кислоты регулируют в зависимости от требуемого расхода газа; ограничения накладывает лишь экзотермичность процесса — не следует допускать сильного разогревания массы. Образующийся газ, по крайней мере в конце процесса, заметно увлажнен и требует осушки.
- В приборе, изображенном на рис. 30, использована высокая осушающая способность концентрированной серной кислоты. Выделяющийся газообразный HCl эффективно осушается в елочном дефлегматоре медленно стекающей концентрированной H2SO4; выходящий из прибора газ практически не требует очистки. Вместо конц. HCl в колбу можно поместить жидкую кашицу из конц, HCl и тонкоизмельченного NaCI.
- Наконец, из трех капельных воронок и трехрогого форштосса можно собрать простой и эффективный прибор (рис. 31) для непрерывного получения HCl с производительностью до 1 л газа в минуту. Полное смешивание концентрированных соляной и серной кислот происходит на рыхлом слое стеклянной ваты, которой набивают реакционную воронку. Основная сложность состоит в регулировании параллельного прикапывания: в реакционную зону должны поступать равные объемы кислот. Отработанную жидкость сливают периодически, поддерживая уровень ее в нижней воронке от 1/2 до 1/з объема. Поскольку сливаемая жидкость сильно пахнет HCl, ее разбавляют большим объемом воды.
Получение аммиака
- Способ, заключающийся в добавлении по каплям 60% раствора КОН, к твердой соли NH»C1 и нагревании смеси, имеет тот же недостаток, что и получение HCl из NaCl, а именно неравномерность выделения газа. Нельзя не считаться также с высокой опасностью работы с концентрированным раствором щелочи.
- Совершенно безопасно и удобно получение аммиака при нагревании тщательно перемешанных NH4CI, Са(ОН)2 и воды в весовых соотношениях 5:7:10. Замена Ca (ОН) 2 на КОН или NaOH возможна, однако гранулированная щелочь реагирует не полностью, а ее измельчение — неприятная и опасная операция.
- Наиболее прост и удобен способ получения газообразного NH3 из его 25% водного раствора, который медленно нагревают в колбе с обратным холодильником. Для"получения непрерывного равномерного тока газа предложен прибор, изображенный на рис. 32. Колбу заполняют водой примерно на '/2 объема и нагревают до 98 °С. Концентрированный раствор аммиака добавляют из капельной воронки с необходимой скоростью. Слив воды из колбы с помощью сифонной трубки (которая должнатЗыть заполнена водой заранее) производят с такой скоростью, чтобы поддерживать уровень постоянным. Отрегулированный прибор дает равномерный ток газа в течение неограниченного времени; эффективность использования реактива довольно высока: в вытекающей жидкости остается не более 2% NH3.